Szabó Áron és munkatársai, az ELKH Szegedi Biológiai Kutatóközpont Genetikai Intézetének Juhász Gábor vezette laboratóriumában az agy fontos sejtjeinek számító gliák lebontó folyamatait kutatták egy modellszervezetben, az ecetmuslicában (Drosophila melanogaster). Felfedezték, hogy a belső anyagok lizoszomális lebontásáért felelős gépezet, az autofágia egyes fehérjéi szabályozzák a rendellenes körülmények – például agysérülések, neurodegeneratív betegségek, stroke – hatására keletkező axontörmelék lebontását, a fagocitózist. Mivel az emlősagyban is ismert már az LC3-asszociált fagocitózis (LAP) az asztrociták törmelékeltakarításában, ez a folyamat lehetséges terápiás célpontként is szolgálhat a későbbiekben. A kutatás eredményeit bemutató tanulmány a Nature Communications szakfolyóiratban jelent meg.
Az agyunk állandó változásban van, nemcsak a kognitív folyamatok terén, hanem fizikálisan is, amely során folyamatosan épülnek és bontódnak fontos alkotóelemek. Rendellenes körülmények között – például agysérülésekben, neurodegeneratív betegségekben vagy stroke, illetve fertőzések esetén – hosszabb-rövidebb ideig ez az egyensúly eltolódhat. A gliasejtek egyik szerepe az agy tisztán tartása mind normális, mind patológiás körülmények között. Sok ismeretünk van arról, hogy a gliák hogyan ismerik fel a lebontandó anyagot, mikrobákat. Azonban sokkal kevésbé kutatott, hogy ezek miként bontódnak le a gliák lizoszómájában, amely a sejt egyik emésztőcentruma.
A gliák lebontó folyamatait az ecetmuslicában (Drosophila melanogaster) vizsgálva a kutatók felfedezték, hogy a sejtek saját anyagainak lizoszomális lebontásáért felelős gépezet, az autofágia egyes fehérjéi szabályozzák a sérüléskor keletkező axontörmelék fagocitózissal történő lebontását.
Ez azért érdekes, mivel a fagocitózis a sejten kívülről származó anyagokat veszi fel és bontja le, ellentétben az autofágiával. Ez az LC3-asszociált fagocitózisnak (LAP) nevezett folyamat a makrofágokban már ismert volt, de az idegrendszerben csak kutatásaikkal párhuzamosan kezdték jellemezni. A kísérleteket a muslica szárnyában futó egyik ideg átvágásával végezték, ami a traumás sérülések egyszerű, reprodukálható és könnyen vizualizálható modellje. A gliák és a neuronok egymástól független genetikai manipulálásával sikerült megmutatni, hogy a LAP-ban már ismert autofágiás, illetve csak LAP-ra jellemző gének és fehérjék működése szükséges a normális törmelékeltávolításhoz. Ezek a fehérjék meg is találhatók a fagocitált axondarabokat tartalmazó vezikulákon.
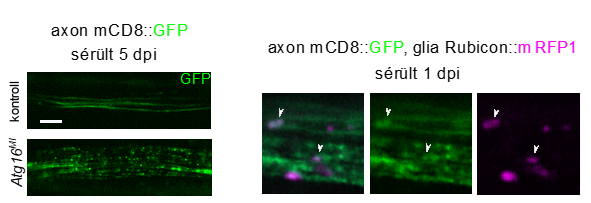
Túl kevés vagy túl sok fagocitikus aktivitás káros lehet az életműködésekre mind a makrofágok, mind a gliák esetén. A LAP hiánya traumás agysérülés után hosszú távon fokozott halálozáshoz vezetett, ami mutatja a LAP általi lebontás jelentőségét. Ennek a végzetes hatásnak az egyik magyarázata a krónikus gyulladás lehet, amely autoimmunitáshoz is vezethet a LAP-hiányos makrofágok esetén. A LAP fokozása a Rubicon fehérje túlműködése révén képes volt gyorsabb tisztulást eredményezni a sérült idegben, ami a gyógyulás egyik előfeltétele. Mivel az emlősagyban is ismert már a LAP fontossága az asztrociták törmelékeltakarítása során, ezért lehetséges terápiás célpontként is szolgálhat a későbbiekben.